自然界中,大多数高等动物新生命的开始都源于父亲精子和母亲卵子的结合。精卵细胞结合形成一个受精卵,新生命就这样诞生了。在生殖过程中,单倍体生殖细胞(精子和卵细胞)负责将父代、母代遗传信息传递给子代。精子和卵子的各自起始细胞,便为生殖干细胞。作为成体干细胞的一种,生殖干细胞具有自我更新能力和向生殖细胞分化的能力,在维持自身数量的同时,不断产生分化的生殖细胞,经过减数分裂形成配子。
研究显示,哺乳动物雄性生殖干细胞只占生殖细胞总数的0.02-0.03%,但这万分之一左右的细胞,却肩负着重要的任务,需要在一生的时间里产生成千上万的精子[1]。正常男性一生大概能产生超过9520亿成熟精子[1]。而在雌性哺乳动物中,正常雌性一生只能产生相对稀少的数目的成熟卵子。如正常女性,一生中只能产生300-500颗成熟卵子。这是否意味着,雌性卵巢中不存在生殖干细胞,或者说生殖干细胞数量极其稀少呢?
1、生殖干细胞的起源
要想全面了解“生殖干细胞 ”,我们先把雌性生殖干细胞的世纪争论先放一放。先看一看,雄性和雌性生殖细胞,最初的来源是哪里?我们先从小鼠胚胎发育开始,随后介绍人类胚胎发育,去看生殖细胞的起源。
1)胚胎时期的生殖细胞
在小鼠胚胎发育过程中,在E7天原肠胚时期开始出现生殖细胞的祖细胞:原始生殖细胞PGC(Primordian Germ Cell)。
E7天是什么意思?就是指胚胎发育的第七天,从受精卵形成开始计时。大家都听说过大名鼎鼎的胚胎干细胞,其具有多能性,能分化成各种类型的细胞,这个大佬就是在E3.5天的囊胚期存在于囊胚内细胞团ICM中。
PGC通过细胞迁移,长途跋涉,E10.5到达胚胎的生殖脊,在此过程中PGC数目逐渐增多,在生殖脊部位定植下来,随后分化为生殖细胞:雄性胚胎中变成精原细胞,雌性胚胎中则形成卵原细胞。
生殖脊经过分化、发育,最终形成雄性性腺睾丸和雌性性腺卵巢,而PGC最终变成了性腺部位的生殖细胞。
一句话, 一切生殖细胞包括生殖干细胞都是来源于胚胎时期的原始生殖细胞PGC。
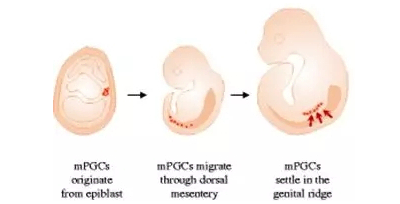
图一:小鼠原始生殖细胞PGC(褐色细胞)在胚胎中的分布变化
原始生殖细胞在胚胎发育时期,从最初的外胚层(epiblast)经过背系膜(dorsal mesentery),最终到达生殖脊(genitarridge)引自Jae Yong Han:…genome editing in birds.”
2)出生后的生殖细胞
那么,胚胎在出生前夜,其精原细胞、卵原细胞会只是安静待在自己的位置睡个大觉么?
卵原细胞不是的,她非常勤奋。雌性小鼠出生(E20)前夜,卵原细胞大量增殖,会进行减数分裂,形成初级卵母细胞。小鼠在出生前形成生千个初级卵母细胞,而女性则达到了百万数量级别,而这些卵母细胞只是停留在第一次减数分裂的双线期,且大部分会在出生后发生程序化死亡。
出生后,睾丸和卵巢还会继续发育。
在睾丸中精原细胞逐步分化,在性成熟时便开始进行精子发生,通过减数分裂和有序分化,依次形成形成初级精母细胞、次级精母细胞、圆形精子,最终圆形精子形成 “蝌蚪形”成熟的精子,形成生殖能力。
卵巢在性成熟时,卵母细胞已经进入到第二次减数分裂,形成了次级卵母细胞,最后通过排卵,进入输卵管,形成生殖能力。
与雌性小鼠卵巢发育过程类似,人类女性出生时卵巢中大约有200万个卵泡(一个卵母细胞+N个颗粒细胞形成一个卵泡),到青春期时则只剩下约30万个。数量貌似巨大,但是正常女性一生大概有约300-500个卵泡可以发育成熟并排卵。
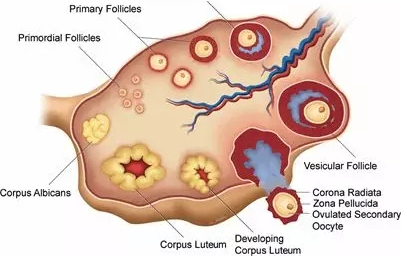
图二、哺乳动物卵巢结构示意图
卵巢中卵细胞与颗粒细胞组成卵泡结构,在排卵周期中,首先原始卵泡(Primordial follicles)发育成初级卵泡(Primaryfollicles)、次级卵泡(Secondary follicles),在形成囊状卵泡(Vesicularfollicle)后,卵细胞脱离卵泡结构,排出卵巢,剩下的卵泡结构逐渐萎缩形成黄体(Corpus luteum)(引自KevinCoward:Mammalian reproductive physiology)
2、寻找你心中的生殖干细胞
在哺乳动物的生殖器官里,充满了各种大同小异的细胞,那么如何从茫茫细胞海洋中得知哪些细胞是生殖干细胞干细胞,哪些细胞不是呢?
1)雄性生殖干细胞的发现
传统观念认为,出生时精原细胞数量是确定的。如果没有一种生殖干细胞来提供精原细胞,导致精原细胞枯竭,那么男性产生精子的能力会迅速消失。
但事实却不是这样,刚才提到,男性一生中能产生超过5250亿成熟精子,具有持续产生精子的能力。那么睾丸中必然存在着这么一种细胞,不断补充精子产生所损耗的精原细胞。这种细胞符合干细胞的标准,即必然存在着雄性生殖干细胞,一方面不断分化补充精原细胞以供精子发生,一方面也不断自我更新,维持自身数目,以避免干细胞资源枯竭。
我们知道,哺乳动物睾丸中弯曲盘旋着大量曲细精管,一个成年人所有曲细精管长度加起来可达260米。这些曲细精管负责精子的产生,成熟后的精子可以通过输精管排出体外。
那么曲细精管的哪个位置,驻扎着干细胞呢?
小鼠性成熟时,睾丸曲细精管则为“中空”结构,包含有处于各种分化时期的生殖细胞:如生殖干细胞、精原细胞、精母细胞等,在管中心附近聚集大量成熟精子,而雄性生殖干细胞则位于管壁附近(图二和图三)。
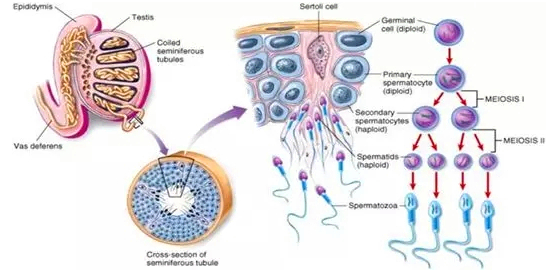
图三、哺乳动物睾丸、曲细精管结构及精子形成过程示意图
睾丸(testis)中存在着大量曲细精管(seminiferous tubule),在曲线精管管壁由外向管中心分别分布着支持细胞(sertoli cell)、精原细胞(germinal cell orspermatogonia cell)、初级精母细胞(primary spermatocyte)、次级精母细胞(secondary spermatocytes)、圆形精子(spermatids)和成熟精子(spermatozoa)
那么雄性生殖干细胞如何发现的呢?
最早在1994年美国人Brinster RL教授首次将小鼠精原细胞(包含有生殖干细胞)注射到无生精能力的小鼠睾丸曲细精管中,使小鼠恢复了生殖能力,首次通过试验证明了小鼠雄性生殖干细胞的存在。随后大量的研究工作,实现了体外分离培养雄性生殖干细胞,并找到了一些标记物如PLZF,来识别体内的雄性生殖干细胞。如下图,就利用Stell4蛋白来标记出了小鼠的雄性生殖干细胞(图三,绿色细胞为生殖干细胞)。
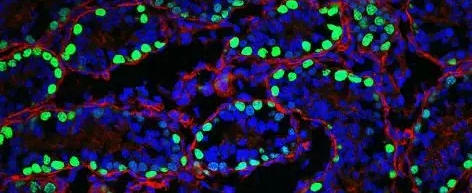
图四、新生小鼠雄性生殖干细胞定位:绿色细胞为Sall4+雄性生殖干细胞
蓝色为细胞核,外圈红色为支持细胞sertoli,显示雄性生殖干细胞位于支持细胞所处的曲细精管外壁附近
人类睾丸曲细精管结构和干细胞定位模式与小鼠类似。但人类雄性生殖干细胞分离后在体外进行长期培养直到2009才成功[4]。
所以,我们可以看出在成体雄性睾丸中,生殖干细胞位于曲细精管外壁附近,且数量稀少,但功能及其强大:如男性的生殖干细胞需要承担起产生超过5250亿成熟精子的任务。
2)雌性生殖干细胞的发现
传统观念依然认为,雌性哺乳动物卵细胞数目在个体出生时,便已确定,不会更新增加,在性成熟后随着不断排卵,不断减少,如正常女性一生中只能产生300-500颗成熟卵子。
这是否意味着,出生后的哺乳动物卵巢中无生殖干细胞存在,使得卵细胞最终走向枯竭,使得女性生育年龄受限在16-50岁。
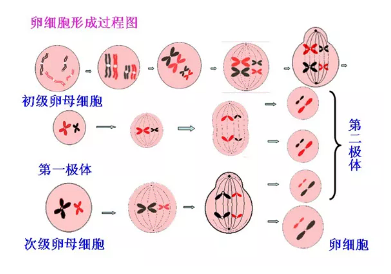
图:卵细胞的形成过程
而近期的研究结果正在挑战这一传统观念,证明出生后卵巢中仍然存在着雌性生殖干细胞,支持着卵细胞更新。
最先发起这一挑战的是Jonathan Tilly和吴际教授。
2004年,Jonathan Tilly教授在哈佛医学院任职期间,发现了成年小鼠卵巢中存在着旺盛分裂的生殖细胞,且通过统计卵巢卵泡数目的变化,证明成年后卵细胞更新仍然存在[5]。这是科学界第一次拿出哺乳动物卵巢生殖干细胞存在的证据。
在2009年,Nature Cell Biology杂志发表上海交通大学吴际教授研究成果。通过磁珠分选技术,成功从小鼠卵巢中分离出雌性生殖干细胞,此干细胞能在体外稳定培养并传代,且通过移植实验,将干细胞移植到无卵泡发生能力的小鼠卵巢后,使受体鼠生育能力恢复,证明了该细胞具有向卵细胞分化的能力[6]。
Jonathan Tilly和吴际教授的工作第一次将小鼠卵巢生殖干细胞进行了定位:卵巢皮质表面(图五)。
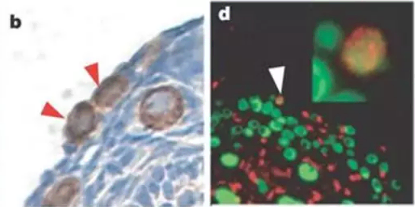
图五、雌性生殖干细胞定位图
利用免疫组化(MVH信号)和免疫荧光(MVH绿色信号、BrdU红色信号)将小鼠卵巢雌性生殖干细胞进行定位,显示其存在于皮质区
在2012年,Jonathan Tilly教授则利用类似的流式分选技术,从人卵巢中分离得到了能进行有丝分裂,且具有卵细胞分化能力的生殖干细胞。
其后,越来越多的研究者从大鼠、猪等哺乳动物中分离得到了雌性生殖干细胞,越来越多的证据支持哺乳动物雌性生殖干细胞的存在。
3)生殖干细胞,未来可期
目前根据中国人口协会12年的《中国不孕不育现状调研报告》,保守估计全国不孕不育的人数已经高达4000万,占育龄人口的12.5%,即每8对夫妇中就有1对有不孕不育问题,北上广等一线城市甚至达到15%以上。
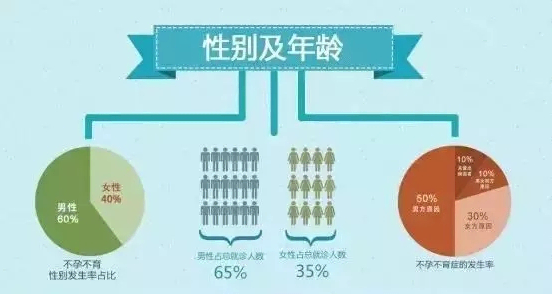
图六、不孕不育年龄及性别比率统计 (引自《中国不孕不育现状调研报告》)
那么,很多人就在想,通过雄性生殖干细胞的研究,是否能解决男性不育问题的方法?或者通过雌性生殖干细胞的研究,是否能找到延长女性生育时间、延缓女性卵巢衰老的好办法?或者说找到解决女性不孕问题的方法?
笔者只能说,前景可期:生殖干细胞的研究,或许是解决这些问题的钥匙之一。
1)产前筛查
如利用生殖干细胞鉴定与不孕不育相关的基因突变,为产前筛查提供参考。已有资料显示,在男性不育方面,遗传因素导致的不育占比为4%。单基因/多基因突变或者染色体畸变通过影响精原干细胞功能或者微环境(niche)变化,最终导致干细胞缺失或精子发生受阻[7]。
2)药物开发
如利用生殖干细胞研究与生殖细胞分化、增殖的关键通路,为药物设计提供靶点。利用靶标药物,对干细胞相关通路进行抑制或者激活,加强人体生精的功能、排卵功能,治疗弱精子症、少精子症等。
3)细胞储存
或者提供生殖干细胞的储存服务,为高危辐射环境工作人员、化疗和放疗患者等提供干细胞提取、扩增和储存方案,保护其生育能力。
总的来说,现实很残酷,但未来可能很美好。随着干细胞技术的发展,相信生殖干细胞能更多地造福于人类。
希望早日实现From bench to beside。
参考文献:
1 Sharma S, Wistuba J, Pock T, et al.Spermatogonial stem cells: updates from specification to clinical relevance[J].Human reproduction update, 2019.
2 Han J Y, Park Y H. Primordial germcell-mediated transgenesis and genome editing in birds[J]. Journal of animalscience and biotechnology, 2018, 9(1): 19.
3 NegusN C, Berger P J. Mammalian reproductive physiology[M]//Current mammalogy.Springer, Boston, MA, 1987: 149-173.
4 Sadri-ArdekaniH, Mizrak S C, van Daalen S K M, et al. Propagation of human spermatogonialstem cells in vitro[J]. Jama, 2009, 302(19): 2127-2134.
5 JohnsonJ, Canning J, Kaneko T, et al. Germline stem cells and follicular renewal inthe postnatal mammalian ovary[J]. Nature, 2004, 428(6979): 145.
6 Zou K,Yuan Z, Yang Z, et al. Production of offspring from a germline stem cell linederived from neonatal ovaries[J]. Nature cell biology, 2009, 11(5): 631.
7 SharmaS, Wistuba J, Pock T, et al. Spermatogonial stem cells: updates fromspecification to clinical relevance[J]. Human reproduction update, 2019.
版权声明:文章转载自干细胞者说,如涉及版权问题,请联系删除!